A tradução e rotulagem de passagens esclarecdedoras do artigo a seguir delineiam, na minha opinião, a essência do problema da osteonecrose gordurosa degenerativa na mandíbula (FDOJ): a adipogênese mal direcionada na medula óssea da mandíbula como pré-requisito para RANTES superexpressa /CCL5 sinalização. Gostaria de disponibilizar esta esclarecedora investigação aos membros do ICOSIM;
Sinceramente
Johann Lechner e Regeane Kaniak
A etiologia de doenças imuno-inflamatórias crônicas comDefinindo linhagens de osteoblastos e adipócitos na medula óssea
J.L. Pierce3, D.L. Begunb, J.J. Westendorf*’’1, M.E. McGee-Lawrencea,d‘”
** Departamento de Biologia Celular e Anatomia, Medical College of Georgia, Augusta University, Augusta t GA, EUA b Departamento de Cirurgia Ortopédica, Mayo Clinic, Rochester, MN, EUA c Departamento de Bioquímica e Biologia Molecular> Mayo Clinic, Rochester, MN , EUA d Departamento de Cirurgia Ortopédica, Augusta University, Augusta, GA, EUA
Autor correspondente:
Endereço de e-mail: mmcgeelawrence@augusta.edu (M.E. McGee-Lawrence).
https://doi.Org/10.1016/j.bone.2018.05.019
Recebido em 16 de março de 2018; Recebido em formulário revisado em 16 de maio de 2018; Aceito em 16 de maio de 2018 8756-3282/ © 2018 Elsevier Inc. Todos os direitos reservados
- 1. O microambiente da medula óssea é heterogêneo
O osso é um tecido metabolicamente ativo com funções fisiológicas complexas. A medula óssea é um componente semifluido do osso que ocupa o espaço endosteal. Consiste em uma população diversificada de tipos de células, incluindo aquelas envolvidas no desenvolvimento ósseo, hematopoiese, reparo tecidual e regulação endócrina. Muitos dos tipos de células maduras presentes na medula óssea derivam de precursores comuns. Um precursor multipotente, a célula-tronco mesenquimal da medula óssea/estroma (BMSC), compreende uma população heterogênea de células-tronco que podem amadurecer em células condrogênicas, miogênicas, osteogênicas ou adipogênicas ao receber o sinal apropriado [1]. As BMSCs mantêm sua natureza de caule ao longo de seu desenvolvimento, até serem diferenciadas por estressores ou necessidades fisiológicas. Durante a diferenciação de BMSC, ocorrem alterações no perfil de transcrição, metabolismo celular e morfologia, consistentes com a linhagem celular comprometida. Com a idade, e sob condições patológicas, o equilíbrio normal entre as populações de células osteogênicas e adipogênicas pode mudar para o último, ameaçando a saúde e a integridade óssea [2]. Aqui nós olhamos para a relação osteoblasto-adipócito na medula óssea,e esclarecer como esses dois tipos de células podem se parecer. Avanços nesta área podem levar a novos insights sobre a prevenção de fraturas e síndromes metabólicas relacionadas à idade e à patologia.
- Compromisso das BMSC com a diferenciação de osteoblastos ou adipócitos
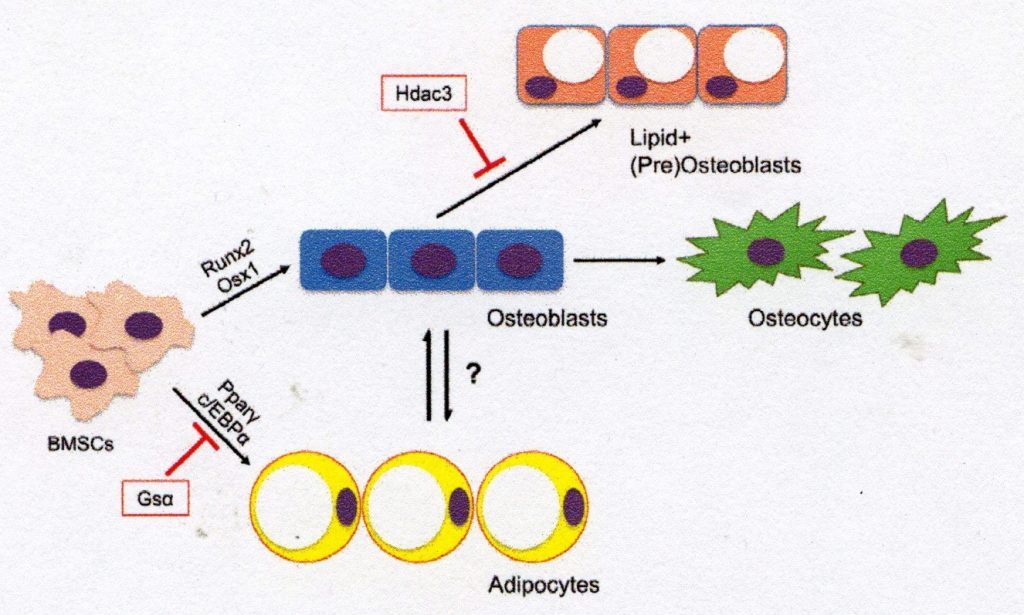
As BMSCs são os precursores multipotentes responsáveis pela manutenção da população de células não hematopoiéticas no osso e na medula óssea. O comprometimento das BMSCs com a osteogênese é um processo estritamente regulado que depende de uma variedade de mecanismos de sinalização durante o desenvolvimento e na idade adulta (Fig. 1). Os primeiros reguladores da osteogênese na população BMSC incluem sinalização Wnt/β-catenina e proteínas morfogênicas ósseas (BMPs), proteínas hedgehog (ou seja, Sonic Hedgehog, Indian Hedgehog), hormônios endócrinos, como hormônio da paratireóide (PTH), reguladores epigenéticos e vários fatores de crescimento [3-5], os principais fatores de transcrição de osteoblastos – fator de transcrição 2 (Runx2) e Osterix 1 (Osx1/Sp7) – desempenham um papel fundamental na indução da diferenciação osteogenética e alteram o perfil de expressão gênica de BMSC para genes osteogênicos que controlam uma matriz extracelular (MEC) de deposição de colágeno tipo 1 [6]. As BMSCs dedicadas à osteogênese desenvolvem ainda mais o perfil genético e a morfologia do osteoblasto e expressam genes como fosfatase alcalina, osteoprotegerina, colágeno tipo 1 e, posteriormente, osteocalcina, à medida que essas células mudam para uma morfologia de osteócitos terminais [7]. Em adultos, a principal tarefa dos osteoblastos derivados de BMSC é produzir e secretar fatores osteóides e de mineralização que estão associados à atividade dos osteoclastos (que reabsorvem a matriz óssea) para remodelar o osso de acordo com as necessidades metabólicas e estruturais do corpo. Nos casos em que a BMSC não está comprometida com a osteogênese, a formação óssea pode ser dissociada da reabsorção, diminuindo a densidade óssea e a integridade do tecido [8]. Fig. 1. Diferenciação de BMSCs em linhagens osteogênicas e adipogênicas. As células-tronco do mesênquima da medula óssea (BMSCs) são diferenciadas em osteoblastos por fatores de transcrição como Runx2 e Osxl ou por adipócitos via PPAR-γ e C/EBPa. Os osteoblastos derivados de BMSC podem se diferenciar em osteócitos maduros ou tornar-se tipos de células armazenadoras de lipídios. Este diagrama ilustra um possível mecanismo de rearranjo osteoblasto-adipócito e redução do armazenamento de lipídios em células osteogênicas via histona desacetilase 3 (Hdac3) e seus cofatores associados.
Adipócitos
Sob certas condições, as BMSCs podem, alternativamente, ser direcionadas para adipogênese. De fato, alguns consideram a diferenciação de BMSC na linha de adipócitos como o caminho ‘padrão’ [9]. A diferenciação de BMSC em adipócito da medula óssea envolve a expressão dos principais fatores de transcrição: receptor gama ativado por proliferador de peroxissoma (PPAR-γ) e proteína CCAAT/enhancer-binding protein a (C/EBPa) [10]. Os adipócitos da medula óssea caracteristicamente armazenam gotículas lipídicas citoplasmáticase expressam uma série de genes relacionados ao armazenamento de lipídios (ou seja, Cidec, Plinl), metabolismo de ácidos graxos (ou seja, Fasn, lipases como ATGL e HSL) e função de adipócitos (ou seja, adiponectina, LepR) [11]. Embora o papel dos adipócitos da medula óssea ainda seja desconhecido, há evidências de que essas células podem servir como armazenamento de energia para o osso[12]. Além disso, os adipócitos da medula interagem com outras células ósseas em vários recessos onde podem regular os processos de remodelação óssea, reparo e regulação da glândula [13]. Essas células de armazenamento de lipídios são, portanto, uma parte importante da biologia do esqueleto e podem oferecer novos insights sobre a atividade de osteoblastos e outros tipos de células derivadas de BMSC.

- Energética celular de osteoblastos e adipócitos derivados de BMSC
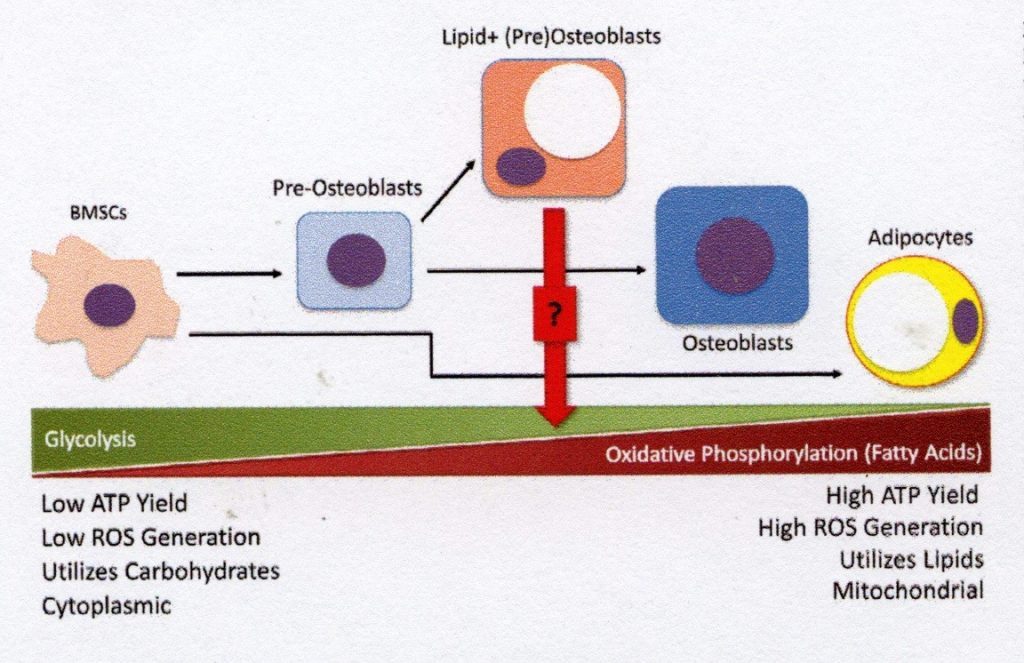
Da mesma forma que diferentes tecidos variam em suas necessidades energéticas devido às suas funções fisiológicas, durante o comprometimento da diferenciação terminal, o perfil energético celular de BMSCs muda (Fig. 2). As células progenitoras mesenquimais dependem principalmente da glicólise para o metabolismo energético, enquanto a necessidade de energia dessas células aumenta dramaticamente durante a osteogênese.[14]. É importante ressaltar que o metabolismo da glicose nas BMSCs é aumentado devido à expressão desregulada do transportador de glutamina, que precede a expressão de Runx2 dentro dos pré-osteoblastos em diferenciação, fornecendo a energia necessária para produzir o colágeno tipo 1 que compreende a MEC [15]. Os osteoblastos maduros também requerem um alto rendimento de ATP de fontes de combustível para produzir e secretar quantidades significativas de osteóides e, portanto, a oxidação de ácidos graxos, além do metabolismo da glicose, para atender a essa necessidade de energia [16]. Enquanto a energia das células osteogênicas em estágio avançado é suficiente para sua função, o uso da fosforilação oxidativa resulta em alta energia. O rendimento pode contribuir para a produção de espécies reativas de oxigênio em excesso que podem causar danos às células ao longo do tempo.
Via de regra, os adipócitos da medula óssea têm necessidades metabólicas diferentes dos tipos de células osteogênicas, o que também se reflete em sua energia celular. Em vez de usar o metabolismo da glicose para produzir energia, essas células armazenadoras de lipídios são caracterizadas por seu metabolismo de ácidos graxos e são altamente dependentes da lipólise de seus estoques lipídicos intracelulares para disponibilizar ácidos graxos livres (AGL) para metabolismo via fosforilação oxidativa . . Graças ao uso de ácidos graxos como gotículas lipídicas intracelulares, os adipócitos da medula podem servir como importantes reservatórios de energia quando outras fontes (por exemplo, glicose) se esgotam. No entanto, um excesso de AGL produzido pelo metabolismo de gotículas lipídicas pode ter efeitos lipotóxicos em BMSCs e osteoblastos, interrompendo a função celular e induzindo a morte celular [18]. Os efeitos nocivos deste metabolismo de ácidos graxos nos osteoblastos podem ser prevenidos pela inibição da síntese de ácidos graxos [19]. A fascinante relação entre as células de armazenamento de gordura e as células formadoras de ossos envolve o crosstalk em nível metabólico. O delicado equilíbrio entre glicólise e fosforilação oxidativa – particularmente de metabólitos lipídicos – em tipos de células osteogênicas e adipogênicas é uma área de interesse ativa que pode oferecer novos insights sobre a manutenção da saúde esquelética.
4. Armazenamento de lipídios em células esqueléticas não adipogênicas
Embora seja claro que tanto os precursores de osteoblastos quanto os adipócitos sejam encontrados na medula óssea, sua identidade pode ser difícil de detectar, uma vez que o acúmulo de lipídios é frequentemente uma característica definidora dos adipócitos, em vez da transcrição definidora da linha fatores. Um dos desafios no estudo histológico da adiposidade da medula óssea é que as gotículas lipídicas nas células d
parte do volume celular, deixando pouco espaço para estudar outras organelas, incluindo o núcleo, onde os fatores de transcrição direcionados à linha são normalmente encontrados. No entanto, as vias bioquímicas e metabólicas que produzem e dissolvem as gotículas lipídicas são as mesmas em todas as células e não explícitas para os adipócitos. Armazenar gotículas lipídicas intracelulares em células de linha não adipogênicas não é um conceito novo. Por exemplo, o armazenamento de lipídios nos hepatócitos do fígado como resultado do aumento do consumo de álcool foi estudado extensivamente. Em contraste, o armazenamento de lipídios intracelulares em linhas de osteoblastos não é amplamente reconhecido atualmente por especialistas em osso, apesar da crescente evidência da existência desse mecanismo.O consumo crônico de álcool resulta no aumento da deposição de lipídios intracelular nos osteócitos, que muitas vezes precede a apoptose dos osteócitos e a osteonecrose relacionada à doença [20]. Também foi demonstrado que os condrócitos contêm lipídios intracelulares e que sua frequência aumenta com a idade [21].Deslocamento de perfis de energia celular por diferenciação BMSC. A população precursora de BMSC é altamente glicolítica e depende da glicose para seu metabolismo energético. Como as BMSCs estão comprometidas com a osteogênese, as necessidades energéticas da produção de osteóides requerem processos metabólicos que produzam mais ATP – por exemplo, o metabolismo de ácidos graxos para fosforilação oxidativa. Os osteoblastos mais antigos usam uma combinação de glicólise e fosforilação oxidativa para atender às suas necessidades energéticas. No entanto, esse equilíbrio deve ser rigorosamente regulado para reduzir a formação de espécies reativas de oxigênio (EROs) e os danos celulares subsequentes. Em contraste com as BMSCs maduras, os adipócitos produzem uma grande porção de seu ATP por oxidação de ácidos graxos e fosforilação oxidativa. O perfil metabólico dos pré-osteoblastos lipídicos positivos ainda é desconhecido, mas a morfologia intermediária desse tipo celular sugere que em momentos de alta exigência energética ela pode armazenar tanto processos energéticos quanto gotículas lipídicas para o metabolismo de ácidos graxos.
Embora o armazenamento de lipídios nos osteoblastos tenha sido considerado potencialmente prejudicial nos estudos acima mencionados, também foi sugerido como um passo crucial na osteogênese. O uso de Triascina C para impedir a formação de gotículas lipídicas em BMSCs causou uma diminuição notável na diferenciação de osteoblastos, conforme medido pela fosfatase alcalina e coloração de von Kossa [43]. No entanto, embora o acúmulo de gordura nos osteoblastos esteja frequentemente associado a condições patológicas, os papéis fisiológicos dessas células armazenadoras de lipídios permanecem incertos e podem variar de acordo com o estágio de diferenciação osteoblástica.
Apesar da possibilidade de que as gotículas lipídicas suportem a função dos osteoblastos, é importante notar que o armazenamento do excesso de gordura da medula óssea pode afetar adversamente a densidade óssea e a saúde dos tecidos se a deposição de lipídios exceder a energia necessária para diferenciar as BMSCs. O tecido adiposo na região metafisária da cavidade da medula óssea tende a ocupar um espaço que poderia conter o osso trabecular, e há evidências crescentes de que o metabolismo da gordura da medula óssea pode dificultar a formação óssea.[44, 45]. A lipólise das gotículas lipídicas dos adipócitos pode liberar ácidos graxos, como palmitato, interferindo na diferenciação e função dos osteoblastos, interrompendo os mecanismos de sinalização de β-catenina e Runx2 [18, 19]. Além disso, o acúmulo de ácidos graxos livres pode ter efeitos lipotóxicos nos osteoblastos, induzindo mecanismos autofágicos e apoptóticos, levando à perda óssea a longo prazo.
Alto rendimento de ATP Alta geração de ROS utiliza mitocôndrias de lipídios.
 Hohe ATP-Ausbeute Hohe ROS-Generation Verwendet Lipide Mitochondrien
Hohe ATP-Ausbeute Hohe ROS-Generation Verwendet Lipide Mitochondrien
- A identidade do osteoblasto de adipócitos
A deposição de lipídios intracelulares em osteoblastos levanta preocupações quanto à identificação de adipócitos da medula, bem como o propósito de armazenamento de lipídios no osso. Embora a identidade molecular das células não adipogênicas armazenadoras de lipídios na medula óssea ainda esteja em um estágio inicial, especula-se que essas células possam representar um estágio intermediário entre os parâmetros de diferenciação osteogênica e adipogênica. Uma vez que BMSCs são os precursores comuns de osteoblastos e adipócitos, a sobreposição em suas morfologias indica um potencial para transdiferenciação entre tipos de células (em vez de uma diferenciação terminal) sob certas condições fisiológicas [47].
6. Resumo e direções futuras
…O compromisso do BMSC com a osteogênese é um caminho importante durante a embriogênese, crescimento esquelético e remodelação óssea para garantir a função correta do tecido. A geração de osteoblastos a partir de BMSCs depende de mecanismos de sinalização estritamente regulados (por exemplo, sinalização Wnt/β-catenina), fatores hormonais (por exemplo, PTH, glicocorticóides), reguladores epigenéticos (por exemplo, Hdac3) e a atividade de fatores de transcrição específicos, como Runx2 e Osxl. Os osteoblastos derivados de BMSC expressam genes e proteínas associados à produção de osteóides (que se convertem em uma matriz óssea calcificada), e esse processo intensivo em energia tende a mudar o perfil energético dessas células de um perfil predominantemente glicolítico para um mais complexo e que inclui fosforilação oxidativa.
Há evidências crescentes de que a diferenciação de BMSCs em populações osteogênicas, adipogênicas e condrogênicas requer etapas intermediárias e que tipos de células de transição podem existir.O interessante para os propósitos deste artigo é o acúmulo de gotículas lipídicas em células não adipogênicas – fenômeno que ocorre em vários tecidos moles do corpo durante o envelhecimento e em determinadas patologias. Um argumento para o aumento do armazenamento de lipídios na medula óssea é que as células que são positivas para marcadores osteogênicos são capazes de usar gotículas de lipídios como reservas de energia sob condições energeticamente desafiadoras. Outro argumento plausível para a deposição de lipídios osteogênicos é que a adipogênese é o padrão de comprometimento padrão das BMSCs. Como tal, reguladores epigenéticos e mecanismos de sinalização produzidos pelo microambiente da medula óssea podem regular negativamente a adipogênese em favor da formação óssea e sua perda de função. Reguladores(por exemplo, devido ao envelhecimento, estresse ou condições patológicas) pode desencadear a reversão da ligação osteogênica. Essa etapa de ‘desdiferenciação’ pode ser uma etapa intermediária na mudança da linha que pode favorecer a adipogênese, mas as técnicas atuais para rastrear as células em questão limitam esses esforços de pesquisa. Uma escola de pensamento emergente na pesquisa de gordura na medula óssea sugere que osteoblastos e adipócitos podem sofrer o fenômeno conhecido como transdiferenciação, ou uma mudança entre as morfologias desses tipos celulares terminais, em vez de uma etapa intermediária de diferenciação. Apesar das evidências recentes, ainda é difícil confirmar se as observações de transdiferenciação são reais ou devido às condições em que as BMSCs são cultivadas, pois os substratos disponíveis e as fontes de combustível nos meios de cultura podem influenciar a ligação dessas células a linhagens específicas.
Tagged Adipogênese Adipócito , Envelhecimento , Medula Óssea , Gordura da medula , Célula Mesenquimal/Estromal , Osteoblasto , Osteogênese
Deixe uma resposta
Você deve estar logado para postar um comentário.

 Deutsch
Deutsch English
English Português do Brasil
Português do Brasil Español
Español