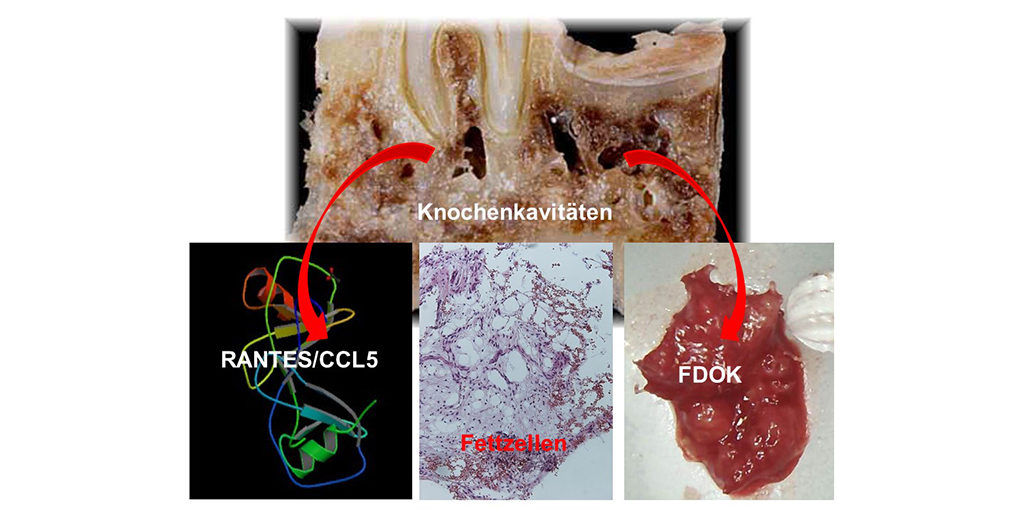
International College of Maxillo-mandibular Osteoimmunology (ICOSIM)
Die Gesellschaft wurde am 21. Januar 2015 in München gegründet und als eingetragener Verein in das Vereinsregister München eingetragen.
Informationsvorsprung dank hochaktueller
Wissensdatenbank
Mit ICOSIM greifen Sie auf den aktuellsten Pool wissenschaftlicher Erkenntnisse zu Maxillo-mandibulären Osteoimmunologie zu.
Stärkung des Forschungsgebiets der Maxillo-mandibulären Osteoimmunologie
Fördern Sie mit Ihrer Unterstützung und Ihrer Arbeit die Erkenntnisse der modernen Behandlung von immunologisch- und zahnbedingten Erkrankungen.
Profitieren Sie vom fachlichen Erfahrungsaustausch aus der Praxis
Erhalten Sie wertvolle Erkenntnisse für Ihre tägliche Arbeit dank kollegialem Erfahrungsaustausch echter Behandlungsergebnisse.
First advisory council member of ICOSIM brasil
Dr. Regeane Kaniak

Dr. Regeane Kaniak ist die Vertreterin von ICOSIM Brasilien, Zahnärztin mit Spezialisierung auf Chirurgie, Implantate, Akupunktur und kraniozervikale Thermografie. Sie arbeitet in Paraná-Brasilien in ihrer eigenen Praxis für integrative und biologische Zahnmedizin. Autor zusammen mit Dr. Johann Lechner des Buches "Cavitational osteonecrosis of the jaws" in portugiesischer Sprache, und Professor des Kurses für maxillomandibuläre Osteoimmunologie, chirurgische Entfernung von Störfeldern, FDOJ, Nico und auch Professor für Oral Acupuncture Microsystem, MAB Methode. Dr. Regeane Kaniak ist Mitglied der IAOMT und das erste Mitglied von ICOSIM in Brasilien. Autor mehrerer Vorträge und Seminare zur Kieferosteoimmunologie. https://www.osteoimunologia.com.br